안녕하세요. 별구 입니다.
의약품동등성시험 심사자료 평가시 일반적 고려사항(8개정)이 공개 되었습니다.
이 지침서는 의약품동등성시험 심사자료 평가시 일반적 고려사항의 세부지침을 정한 것 입니다.
의약품동등성시험 심사자료 평가시 일반적 고려사항(8개정)' 는 '2024년 8월 30일' 자로 식품의약품
안전처의 홈페이지에 게시 되었습니다.
원료약품 및 그 분량 변경수준에 따라 실시하여야 하는 의약품동등성시험의 종류

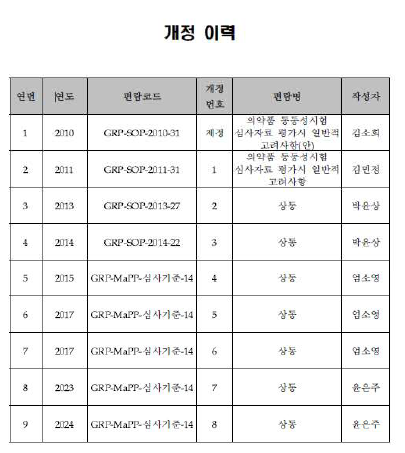
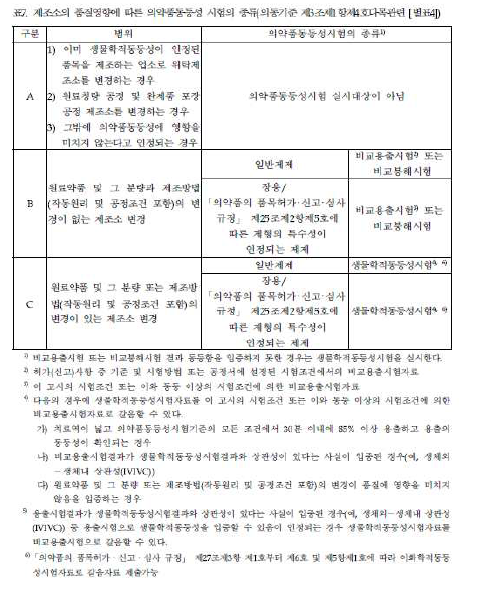
제조소의 품질영향에 따른 의약품동등성 시험의 종류
일반제제, 장용성 및 서방성제제의 동등성 판정기준

자세한 사항은 첨부자료 확인 부탁드립니다.
의약품동등성시험을 진행할 때 참고자료로 활용하면 좋을 것 같습니다.
반응형
'품질보증(QA) > 안내서_지침서 등' 카테고리의 다른 글
| 유전자치료제 비임상 생체분포시험 가이드라인(민원인 안내서) (1) | 2025.01.17 |
|---|---|
| 의의약품 잔류용매 기준 질의응답집(민원인안내서) (0) | 2025.01.17 |
| 한약(생약)제제 허가 후 제조방법 변경관리 가이드라인(민원인안내서) (0) | 2025.01.17 |
| 한약(생약)제제 동등성시험 결과보고서 심사 수행절차(공무원지침서) (0) | 2025.01.17 |
| 의약품 중 불순물 분석법 자료집 (1) | 2025.01.16 |